La EnergÃa En Las Reacciones QuÃmicas
Que son las reacciones químicas que absorben calor siendo por tanto la energía final entalpía de los productos mayor que la energía inicial de los reactivos. Hay muchas reacciones químicas que cuando se producen originan una elevación de temperatura del recipiente de reacción.
Reacciones Quimicas Presentado Por Yina Isabel Torres Restrepo
Las reacciones químicas requieren energía de activación para iniciar.

La energÃa en las reacciones quÃmicas. Video donde se presentan las características de los cambios energéticos en las reacciones químicas. LA ENERGÍA LIBRE DE GIBBS DE UNA REACCIÓN La tendencia de una reacción química y de un proceso en general va a depender de tres factores. Por lo tanto se dice que una reacción endotérmica tiene una entalpía positiva de reacción Esto significa que la energía requerida para romper los enlaces en los reactivos es más que la energía liberada cuando se forman nuevos enlaces en los productos.
En las reacciones endotérmicas los productos tienen más entalpía que los reactivos. El estudio de las reacciones químicas desde un punto de vista energético mejora la descripción de los procesos químicos. Las reacciones químicas son las interacciones entre los diferentes elementos que resultan en la creación de nuevas sustancias.
Ejercicios sobre la energía en las reacciones químicas II Ejercicio 1 Tenemos que determinar el calor de formación del monóxido de carbono a partir de sus elementos sabiendo que. LA ENERGIA EN LAS REACCIONES QUIMICAS. Energ Í a de las reacciones quimicas Una reaccion química consiste en la transformación de unas sustancias denominadas reactivos en otras sustancias diferentes llamadas productos.
V En lugar de expresar las cantidades en moles normalmente se hace en concentración y en este caso las unidades serán molesLseg. Combustión cambio quÍmico liberando energÍa al ambiente o absorbiendo energÍa del ambiente depende de reactivos y productos se puede calcular se cuantifica en joules o calorías en los lÍmites del sistema tomada del ambiente reaccion endotermica la energÍa puede ser. La entalpía es el contenido energético en una reacción química y cambia al pasar de los reactivos a los productos.
C grafito 12O2 CO gas ΔH. Las reacciones químicas convierten unas sustancias químicas los reactantes en otras los productos. Esto sucede porque sólo se lleva a.
Aunque la quema de glucosa libera energía la glucosa no se prende en llamas como tal. Descripción de los procesos energéticos involucrados en las reacciones químicas y clasificación de estas en endotérmicas o exotérmicas. En aquellas reacciones en las cuales las condiciones de presión y temperatura se mantienen constantes la diferencia ðH de contenido energético del sistema entre los estados final e inicial o lo que es lo mismo la energía puesta en juego en el proceso coincide con el calor de reacción que aparece de forma explícita en la ecuación termoquímica.
La totalidad de las etapas por las que. Las reacciones químicas siempre se acompañan de un cambio en la energía. Todas las reacciones químicas desprenden energía o requieren un aporte neto de energía.
Así la reacción directa produce energía eléctrica al contrario de la reacción inversa que consume energía. Podemos relacionar esos cambios con un contenido calorífico de cada una de las sustancias químicas que intervienen. De esta forma la variación de energía es positiva.
Una reacción química se produce cuando las sustancias participantes en ella se transforman en otras distintas. Las reacciones de óxido-reducción en este caso son reversibles. En otras palabras la.
Cuál es el origen de esa energía liberada al producirse la reacción. La siguiente es la reacción global para los procesos de carga y descarga en las baterías para autos. Esta observación lleva a un concepto importante.
Una reacción química no hace una sustancia perder energía. Es decir si los reactantes iniciales contienen más energía que los productos finales. Una bola desciende a través de un plano inclinado hasta que encuentra la posición más baja que es la de menor.
A las primeras se les llama reactivos y a las segundas productos. Energía en las reacciones químicas. La masa de las sustancias participantes es la misma antes y después de la reacción es decir se conserva.
Convierte la energía en una forma diferente como el calor. De acuerdo con la energía envuelta en las reacciones químicas estas pueden ser clasificadas de. El ejemplo más conocido son las combustiones.
Todas las reacciones químicas incluso las que continúan de forma espontánea requieren un aporte inicial de energía para realizarse. La entropía es el grado de desorden en una reacción química y determina el que una reacción. Una reacción es exergónica si libera energía.
Reciben el nombre de exotérmicas. Generalmente las reacciones transcurren en más de una etapa. Como en toda la naturaleza también en las reacciones químicas funciona el principio de la energía mínima según el cual los sistemas materiales tienden a evolucionar en la dirección en la que su energía potencial disminuye.
La cinética química estudia la velocidad a la que ocurren las reacciones químicas el camino que éstas siguen para pasar de reactivos a productos mecanismos de reacción y los factores que condicionan dicha velocidad. La variación de energía la variación de entropía y la temperatura. Dado que en una reacción química se producen ruptura y formación de enlaces se produce una transferencia de energía entre el sistema y el medio que lo reodea.
La solución electrolítica es ácido sulfúrico al 38. La velocidad e reacción de los reactivos es negativa puesto que como se van gastando la variación de concentración siempre será negativa y para los productos la velocidad es positiva puesto que se van formando y cada. Entalpía Δ H Ordinariamente es posible medir los cambios de energía que ocurren durante las reacciones químicas midiendo las cantidades de calor absorbidas o desprendidas.
Todas las reacciones exergónicas liberan parte de su energía. C grafito O2 gas CO2 gas 94 kcal 1 CO gas 12O2 CO2 gas 676 kcal 2 La reacción de formación es.

Estas Son Las Formulas Que Muestran De Talladamente Una Reaccion Ensenanza De Quimica Reacciones Quimicas Quimica

Reacciones Quimicas Del Cuerpo By Maria Sol Tapia Gonzalez On Genially

Ppt Reacciones Quimicas Powerpoint Presentation Free Download Id 2100274

Reacciones Quimicas Caracteristicas Representacion Y Clasificacion
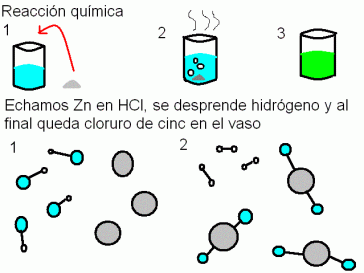
Reacciones Quimicas Ambito Cientifico Matematico Pmar3

Reacciones Quimicas Caracteristicas Representacion Y Clasificacion

Resultado De Imagen Para Tipos De Reacciones Quimicas Tipos De Reacciones Quimicas Notas De Quimica Reacciones Quimicas
Reacciones Quimicas Que Son Tipos Y Ejemplos Que Son Y Tipos Estudianteo

La Energia Y Las Reacciones Quimicas Curso Para La Unam

Reacciones Quimicas Clasificacion Y Ejemplos Quimica En Casa Com

Como Explico Los Intercambios De Energia En Reacciones Quimicas Un1on Puebla

Reacciones Quimicas Martinez Garcia Maria Candelaria

Ndice Reacciones Qumicas Nela Lamos Colegio Alcaste Ndice

Como Fluye La Energia En Las Reacciones Quimicas Biologia
Contratante Para Nao Mencionar Interior Conjunto De Reacciones Quimicas Para Obtener Energia Bandamidas Com

La Energia Y Las Reacciones Quimicas Youtube

Las Reacciones Quimicas Cambios Quimicos Los Cambios Alteran La Naturaleza De Las Sustancias Desaparecen Unas Y Aparecen Otras Con Propiedades Muy Ppt Descargar

Como Modifico La Rapidez De Las Reacciones Quimicas Secundaria Un1on Puebla
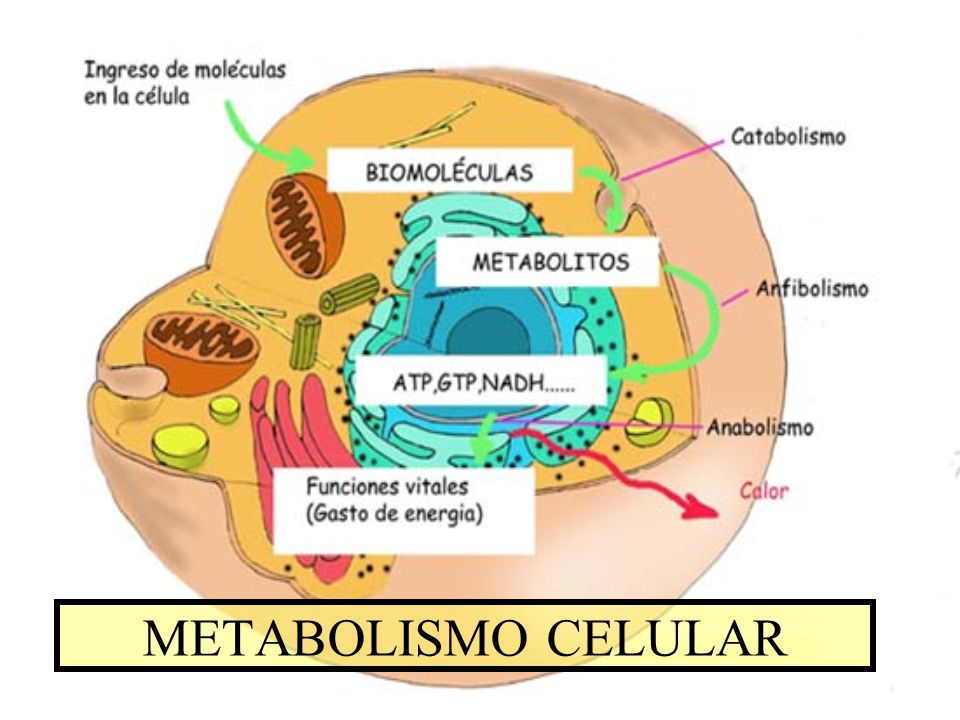
Contratante Para Nao Mencionar Interior Conjunto De Reacciones Quimicas Para Obtener Energia Bandamidas Com
Posting Komentar untuk "La EnergÃa En Las Reacciones QuÃmicas"